La impresión 3D se está convirtiendo en algo habitual, tanto en nuestro día a día (aunque sea para imprimir juguetes) como en el mundo sanitario. Hasta ahora, lo más común era la impresión de modelos para intervenciones quirúrgicas, pero cada vez se ven más prótesis realizadas con la impresora que se implantan en el paciente (es decir, prótesis que estarán implantadas dentro del cuerpo).
Un momento… Pero, ¿la normativa permite este tipo de fabricación de prótesis? Pues sí, de hecho estas prótesis e implantes se incluyen en lo que se conoce como producto sanitario, pero su regulación tiene algunas particularidades que merece la pena destacar. Lo primero es hacer un breve repaso por la nueva normativa que va a regular los productos sanitarios (Reglamento UE 2017/745 del Parlamento Europeo y del Consejo de 5 de abril de 2017 sobre los productos sanitarios) y concretamente dos conceptos importantes: el producto a medida y los productos fabricados y utilizados exclusivamente en centros sanitarios (“in house”). En la actualidad, en España subiste el Real Decreto 1591/2009.
Un producto a medida (artículo 2.3 del reglamento) es todo “producto fabricado especialmente según la prescripción médica de cualquier persona autorizada por la legislación nacional en virtud de su cualificación profesional, en la que constan, bajo la responsabilidad de dicha persona, las características específicas de diseño, y que está destinado a ser utilizado únicamente por un paciente determinado con el fin exclusivo de atender a su estado y necesidades particulares”. Las prótesis 3D parecen estar incluidas en este apartado, como cuentan en este reciente artículo sobre implantes quirúrgicos 3D.
El segundo concepto es el de los productos “in house” que se fabrican y utilizan exclusivamente en un centro sanitario (artículo 5 del reglamento). Estos productos tienen una peculiaridad muy importante: no tienen que cumplir los requisitos de la directiva salvo los “requisitos generales de seguridad y funcionamiento“. Es decir, no tienen que ser autorizados por un organismo notificado, lo que elimina una buena parte de los trámites.
Lógicamente, este tipo de productos son muy específicos y el reglamento los limita mucho:
– Los productos fabricados no se pueden ceder.
– Que exista un sistema de gestión de calidad apropiado (no olvidemos el cumplimiento de los requisitos de seguridad que hemos indicado).
– Que el centro sanitario justifique en su documentación que no pueden satisfacerse las necesidades específicas del grupo de pacientes al que se destinan los productos mediante otro producto equivalente comercializado. Esto es muy importante dado que impide que un hospital decida dejar de comprar prótesis de cadera y las fabrique todas con su impresora 3D. Tiene que ser una necesidad específica para la que no existe un producto comercializado.
– Debe existir un documento técnico con la justificación de su fabricación y uso. Si la autoridad sanitaria solicita esta información al hospital, se deberá suministrar.
– El hospital deberá hacer pública la identificación del producto fabricado y una declaración acreditativa del cumplimiento de los requisitos de seguridad y funcionamiento.
Cada Estado miembro puede restringir la fabricación de este tipo de productos o poner en marcha medidas adicionales de control y seguimiento de la fabricación y el uso. Todo esto debido a que se están fabricando productos a medida sin autorización previa, mientras que un producto similar fabricado en serie de forma industrial requiere autorización previa, como ya hemos comentado.
El artículo que comentamos lo publica Lancet Digital Health y lleva por título “Challenges in the design and regulatory approval of 3D-printed surgical implants: a two-case series“. Los autores son médicos holandeses que explican su experiencia sobre el diseño y fabricación de dos prótesis implantables para pacientes con problemas vertebrales graves. Os recomendamos su lectura pero vamos a comentar algunas ideas del artículo:
* Es muy importante elaborar un documento técnico muy completo para cada paciente, con la evidencia que avala el uso de ese tipo de implante, el análisis de riesgos, el proceso de fabricación y su uso posterior.
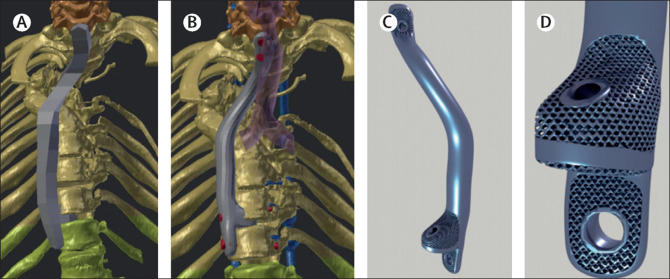
* Para garantizar la calidad del proceso de fabricación, se utilizaron las instalaciones de la Universidad (que está certificada con la ISO 13485 para fabricar productos sanitarios). La impresión se realizó con titanio utilizando para ello una impresora especial 3D para metal. En esta imagen se puede ver como se pasa del prototipo al producto final. El diseño se realizó mediante el software Blender.
* Es importante que todos los procedimientos y herramientas utilizadas estén registradas para su uso sanitario. Pero, ¿qué pasa con el software de diseño? Estos aspectos y muchos otros deben ser desarrollados y resueltos a corto plazo para evitar problemas de calidad y facilitar el uso de este tipo de productos sanitarios a medida.
* Es esencial que el equipo quirúrgico trabaje conjuntamente con un equipo de diseño especializado en productos sanitarios. Por ello es importante que en el hospital exista una unidad de apoyo para todos los servicios que pretendan utilizar productos a medida.
En el apéndice los autores han incluido un resumen del documento técnico, la evidencia que respalda esta solución para cada paciente, el análisis de riesgos, un informe de una agencia de calidad externa para comprobar la compresión biomecánica de la prótesis a medida y la documentación de las dos pruebas que se hicieron con cadáveres.
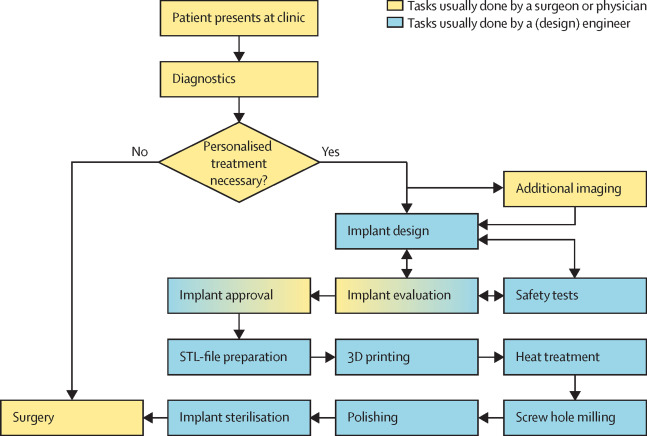
Esta figura resume el procedimiento completo desde el examen del paciente hasta la intervención quirúrgica:
El hecho de que el Reglamento sea nuevo genera muchas dudas a la hora de lanzarse a implantar prótesis fabricadas en el propio hospital. Sin embargo, el artículo que hemos comentado permite conocer el procedimiento completo, los riesgos y problemas asociados y la documentación utilizada para justificar su uso. Conviene, finalmente, extraer algunas conclusiones sobre el uso de implantes 3D fabricados en el propio hospital:
1. Se trata de productos específicos para pacientes concretos, es decir, no pueden utilizarse como alternativa a los productos comercializados. Si hay producto en el mercado, no se puede fabricar uno “in house”.
2. La normativa comunitaria va a eximir a estos productos del cumplimiento de muchos requisitos como el de autorización previa.
3. Es necesario contar un unidades de apoyo especializadas en innovación, diseño industrial, tecnología médica y en gestión de productos sanitarios.
4. Nunca olvidar que estos productos deben cumplir los requisitos de seguridad y funcionamiento, lo que incluye la propia fabricación. Es decir, esto no es comprar una impresora 3D, instalarla en un despacho vacío del servicio y fabricar implantes. Una cosa es imprimir modelos (para preparar una cirugía por ejemplo) y otra imprimir el implante definitivo.
5. Todo implante 3D debe estar documentado y avalado por su propio documento técnico. El cumplimiento de las normas ISO sobre producto sanitario son un aval interesante para garantizar aun más la calidad y seguridad.
6. Respecto de la cesión de estos productos, la norma habla de la prohibición de la cesión, pero ¿se podrían crear unidades centralizadas de fabricación para un grupo de hospitales o para un servicio de salud?
7. Quedan en el aire temas éticos y de responsabilidad. ¿Qué ocurre si hay un fallo de diseño? ¿Y si el error es en la fabricación o en la intervención quirúrgica?
7. Quedan en el aire temas éticos y de responsabilidad. ¿Qué ocurre si hay un fallo de diseño? ¿Y si el error es en la fabricación o en la intervención quirúrgica?

Magnífico artículo, Miguel Ángel. Un buen punto de partida para saber cómo abordar estas cosas y en qué punto están.
Buen resumen,
unos comentarios relativos a la legislación española, que añade algunos requisitos a esta fabricación mediante impresión 3D. Los hospitales pueden fabricar tambien productos sanitarios a medida sin que sean in-house (y por tanto sin justificar que no estan disponibles comercialmente – dificil en muchos casos) mediante una licencia de fabricante de producto sanitario a medida que otorga el departamento de productos sanitarios de la Consejeria de Salud de la Comunidad Autonoma.
Los productos sanitarios a medida en la reglamentación actual de las directivas estan exentos tambien de la intervención de un Organismo Notificado para su evaluacón de conformidad, por lo que los requisitos son similares a los indicados salvo que en España además deberiamos contar con esta licencia.
Con el nuevo Reglamento (EU) 2017/745 que tiene como fecha de aplicación 26 de mayo de 2020 los productos sanitarios a medida que sean implantes de la clase III pasan a precisar de la intervención de un Organismo Notificado.
Ejemplos de implantes a medica de la clase III son los craneales (calotas), las protesis articulares (cadera, rodilla, ..), implantes mamarios, mallas quirurgicas, implantes que incluyan medicamentos / tejidos origen animal-humano, …
Recordar que los productos de bioimpresión que incluyan componentes de origen animal o huano viables no son productos sanitarios sino medicamentos de terapia avanzada cuya legislación tambien incluye una excepción para in-house a medida.