
Hace unas semanas, la revista Lancet Digital Health publicó un interesante estudio sobre la aprobación de los dispositivos médicos relacionados con el machine learning y la inteligencia artificial en Europa y Estados Unidos. El estudio lo firma un equipo de investigadores suizos y lleva por título “Approval of artificial intelligence and machine learning-based medical devices in the USA and Europe (2015–20): a comparative analysis“.
Más allá del análisis que se realiza en el estudio, hay dos conclusiones que queremos destacar y que ponen de manifiesto los diferentes modelos de autorización y aprobación de este tipo de dispositivos tecnológicos en ambos entornos. Por cierto, estas diferencias ya las comentamos en saludconcosas hace unos años.
Por un lado, tenemos una figura muy interesante que compara el plazo de aprobación, es decir, desde la solicitud hasta la resolución final. Curiosamente, en prácticamente todos los casos y para el mismo dispositivo/producto, el plazo es más rápido en Europa.
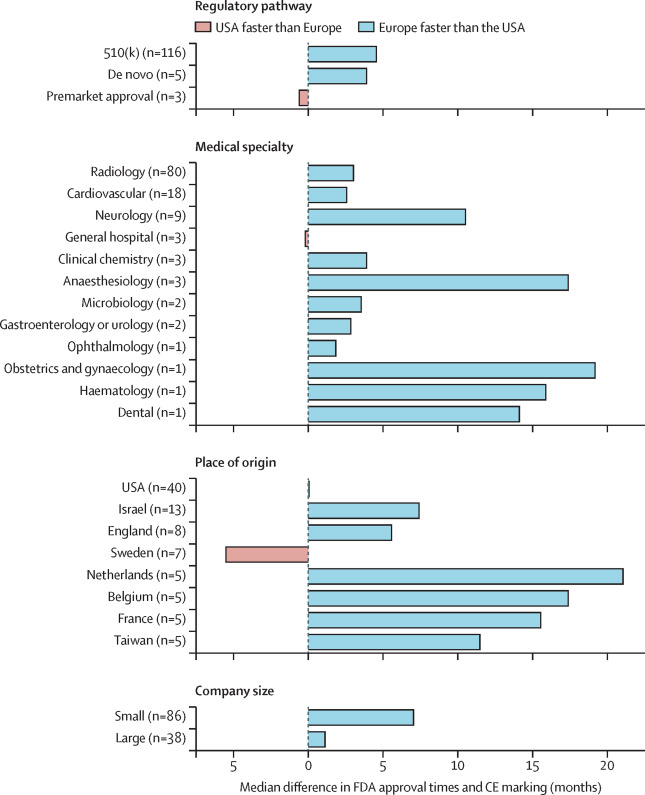
Una posible razón que apuntan los autores es que la evaluación en Europa es menos rigurosa, y por ello es más rápida. Además no hay un organismo central (estilo FDA) sino que la autorización es descentralizada y existen numerosos organismos notificados que pueden realizar la evaluación y aprobación. en esta línea, en un estudio publicado en 2012 se concluye que los dispositivos médicos aprobados antes en Europa que en Estados Unidos suelen tener un riesgo mayor de alertas y retiradas del mercado.
Sin duda, la segunda conclusión es la más llamativa. Los autores no tuvieron problema para encontrar los datos de los dispositivos/productos aprobados en Estados Unidos gracias a la base de datos pública de la FDA que permite conocer los datos de la empresa, del producto y la vigencia de la autorización. Aquí tenéis un ejemplo del informe de un producto. Pero, ¿qué pasa en Europa?
Pues pasa algo muy sencillo: no hay ninguna base de datos pública de todos los productos sanitarios autorizados para su uso en Europa. Así de simple. En teoría, la base de datos Eudamed será accesible en 2022, pero por ahora no se puede saber si un producto está autorizado para su venta en Europa, o si su certificado es correcto o incluso saber sus características o la información aportada por el fabricante para su autorización. Todo esto se ha puesto de manifiesto en la pandemia ya que era muy difícil saber si determinados productos de protección eran legales o no, como cuenta Elena Plaza en este vídeo.
Algunos países europeos (Reino Unido, Austria o Italia) han decidido paliar esta carencia publicando una base de datos mínima con los datos de los productos sanitarios autorizados por los organismos notificados de su país. Pero lógicamente, dado que la autorización de un país es válida en todo el territorio de la Unión Europea, la base de datos global es necesaria para mejorar la seguridad y evitar problemas. La transparencia siempre gana…