Uno de los grandes problemas del deslumbramiento tecnológico es que, ante los nuevos productos sanitarios, es muy fácil convencer de sus bondades y algo más difícil replantearnos su utilidad. En un reciente artículo de JAMA plantean un caso real sobre el uso de la banda gástrica ajustable para la obesidad mórbida en Estados Unidos. Y aunque la parte más técnica (efectividad, recomendación de uso, etc) queda fuera de nuestro alcance, el artículo tiene algunas implicaciones para el ámbito de la gestión que merece la pena comentar.
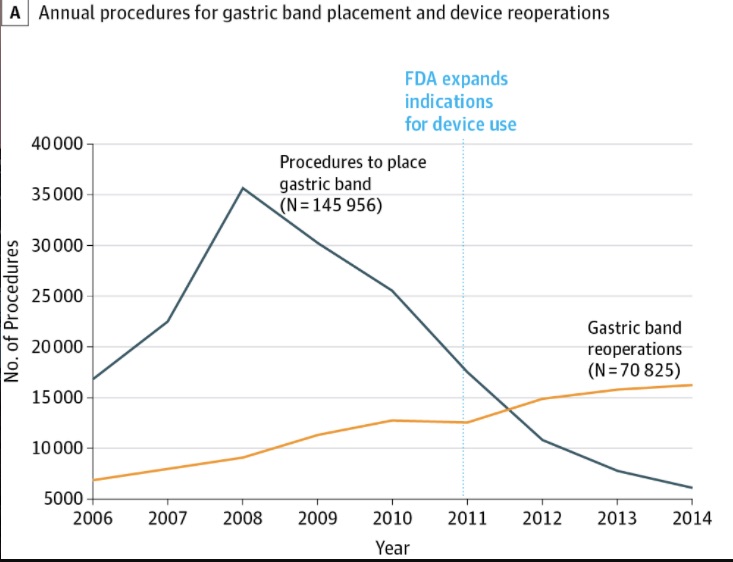
Este dispositivo fue aprobado en USA en 2001 y en 2008 alcanzó su pico máximo de uso (más de 35.000 procedimientos solo en ese año). Sin embargo, durante los siguientes 6 años su uso se fue reduciendo hasta el mínimo y fue acompañado de un incremento continuado en las reintervenciones por las complicaciones que surgieron en muchos pacientes.
De hecho, en un reciente estudio publicado en Annals of Surgery, se revisaron los datos de todos los pacientes adultos intervenidos en Francia con banda gastrica entre 2007 y 2013, con un conclusión clara: este tipo de bandas no son una solución a largo plazo para la obesidad (la tasa de retirada de bandas a los 7 años es del 40%). La revista incluso dedica un editorial a este tema: “Is the adjustable gastric band dead?“
Tal y como señalan los autores del artículo de JAMA, quizás haya algunos fallos en los procesos de evaluación y revisión de dispositivos médicos tras su aprobación inicial. Por ejemplo, en 2011 la FDA amplió las indicaciones para la banda gástrica sin que hasta esa fecha se hubieran publicado datos de eventos adversos. Pero, ¿podrían haber servido los datos administrativos de los centros sanitarios?
La revisión del uso de estos dispositivos es muy sencilla dado que la norma de codificación vigente hasta el año pasado (CIE-9-MC) incluye un código único para la inserción de la banda (44.95) y tres más para la revisión, retirada y ajuste (44.96, 44.97 y 44.98). Por ello, el análisis de los datos en cualquier país que utilice este tipo de norma de codificación es muy sencillo. De hecho, una de las peticiones de los autores es que exista un desglose similar para otros dispositivos implantables que permitan conocer las tasas de revisión o retirada sin tener que recurrir a registros locales o de tipo secundario.
En el caso de España, partimos de un uso todavía muy bajo de este dispositivo sin que en ningún caso sea posible extrapolar los datos de los artículos citados a nuestro entorno. De hecho, en 2015 se publicó un informe de evaluación sobre la banda gástrica con la siguiente conclusión: “La banda gástrica ajustable debe formar parte del catálogo de implantes quirúrgicos al constituir -a pesar de su baja utilización en España, la variabilidad y las tendencias decrecientes en algunos países- uno de los procedimientos más comunes y aceptados de cirugía bariátrica“. Tal y como comenta la guía, para minimizar las tasas de revisión y retirada es esencial elegir adecuadamente a los pacientes susceptibles de intervención así como establecer unos mínimos de actividad en los centros que utilicen el dispositivo.
La disponibilidad de datos y la agilidad en su tramitación (tener datos a tiempo) son esenciales para garantizar una evaluación adecuada de los dispositivos implantables. Sin embargo, en España es difícil contar con datos ya que en el ámbito de los dispositivos implantables no hay mucha información. Un ejemplo similar es el del proyecto del registro nacional de implantes por artroplastias (como el de Suecia por ejemplo) que ha sido propuesto en este informe de 2015, elaborado por la Sociedad Española de Cirugía de Cadera, y en el que se indicaba lo siguiente: Por ello, la vigilancia post-comercialización de los implantes ortopédicos, y en particular de los ampliamente utilizados implantes articulares de cadera y de rodilla, es claramente necesaria dado la carencia de evaluaciones de calidad y seguridad, a corto y largo plazo, disponibles a la hora de la toma de decisiones medicas. […] Hay un retraso notable en la detección de las complicaciones y riesgos, y por tanto,
los problemas asociados a los implantes se identifican a medio o largo plazo. Como consecuencia,
miles de pacientes son tratados antes de que las autoridades y profesionales reaccionen ante un posible riesgo para la salud.

El nuevo reglamento de producto sanitario
Este es un ejemplo de las lagunas alegales que existen en los reglamentos y legislación de los productos sanitarios.
Cara al nuevo reglamento de la Unión Europea, que nos afecta ya a todos, aunque hay un periodo de gracia de 3 años. El control y trazabilidad de los productos sanitarios postventa es más severo, sobre todo para evitar situaciones como estas. Pero también es un desafío para los fabricantes, autoridades y usuarios ya que hay grandes retos que afrontar y que no están definidos.
Enhorabuena por el blog. Seguiremos leyéndote.
Rubén
Gracias Rubén! A ver si el nuevo reglamento ayuda a evitar los problemas que hay encima de la mesa, como la imposibilidad de saber en que NB se ha intentado aprobar un producto y se ha denegado.
Saludos
Interesante la información