Uno de los ejes de la política farmacéutica y del uso racional del medicamento es la evaluación constante de su eficacia, de su seguridad y de su coste. El objetivo de dicha evaluación es conocer la aportación terapéutica de cada medicamento en relación con la evidencia existente y así informar al profesional y a los servicios de salud de cara a mejorar la prescripción.
Sin embargo, y pese a que la evidencia debería ser homogénea e interpretada de forma similar, la realidad es muy diferente. A través de un artículo de El Global, titulado “¿Por qué el fármaco innovador en Bélgica no aporta nada en Alemania?” encontramos un interesante Working Paper de julio de 2013 editado por la OECD sobre “Value in pharmaceutical pricing“.
Uno de los ejemplos que incluye es el de fingolimod, ya que para este principio activo cada país piensa una cosa diferente.
Diferentes aportaciones terapéuticas, diferente coste por qaly… Una buena explicación sobre los motivos la podéis encontrar en el citado artículo de El Global. ¿Es necesario que todos los países opinen lo mismo? ¿O en la variedad está la evidencia? Por otra parte, ¿sería conveniente que la forma de clasificar los nuevos medicamentos sea común o mejor que cada país utilice su propia terminología?

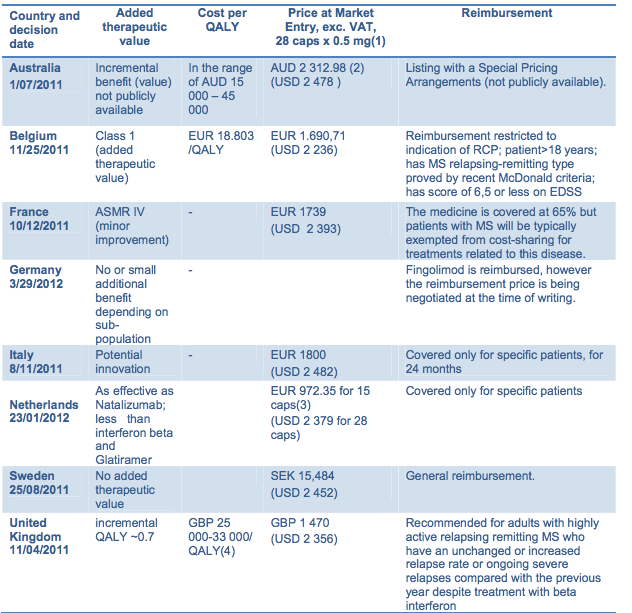
No hay que irse tan lejos, en las diferentes CCAA tenemos casos similares, accesos diferentes a un mismo fármaco en base a la evaluación de cada una. Abiraterona, los nuevos IPs para hepatitis C y un largo etc más.
Me gusta la palabra que usan algunos de "armonizar" el acceso a los medicamentos, pero hoy por hoy creo que no se está consiguiendo.Es uno de los grandes retos que nos queda por delante.
Un abrazo